4 月10日 具有双重保护和双重功效的赛福硒Selsaf®是硒的天然来源

1817 年,Berzelius 首次分离出硒(Se),由于当时对硒的生物学功能知之甚少,直到大约 140 年后 Schwarz 和 Foltz在1957 年揭示了硒的营养需求(Mehdi 等,2013)。 从那时起,硒被认为是一种必需的微量元素,给养殖动物补充硒已成为世界范围内的普遍做法,因为硒缺乏会增加畜禽对各种疾病的易感性并降低畜禽的生产和繁殖性能(Lyons et al., 2007)。
硒发挥积极作用在于第21个氨基酸——硒代半胱氨酸(SeCys)的构建。SeCys也称为硒蛋白,其存在于多种蛋白质的活性位点,在抗氧化防御和免疫功能中发挥重要作用。 作为已鉴定出的最重要的硒蛋白之一,谷胱甘肽过氧化物酶 (GPx)可直接减少过氧化氢 (H2O2) 和磷脂酶(A2)裂解脂质氢过氧化物,从而降低细胞中脂质和蛋白质氧化水平,最终降低细胞中的脂质和蛋白质氧化水平 (Brown 和 Arthur, 2001)。
酵母和动物体内的硒代谢
如今,养殖动物可以以无机或有机形式补充硒。这些无机硒主要是无机盐,如亚硒酸钠 (SS)或硒酸盐,而有机形式是蛋氨酸硒(SeMet) 或富含天然硒成分的酵母硒。酵母硒可以通过不同的方式生产,但产品高度一致性的酵母硒“赛福硒Selsaf®”是专有酿酒酵母 (CNCM I-3399) 菌株在富含SS的培养基中商业化发酵获得的。在酵母的生长过程中,SS会转化为硒化氢 (H2Se)。H2Se是酵母用于合成不同有机硒分子的中间代谢物,例如蛋氨酸硒 (SeMet) 和半胱氨酸硒(SeCys),以及许多其他硒活性成分(Kieliszek等人,2015年)。结果表明,由于标准化的生产程序,赛福硒Selsaf®含有2种天然有机硒成分,一种是63% SeMet和另一种是36% SeCys和其他活性硒成分,它们很容易被动物肠道吸收。蛋氨酸硒SeMet与蛋氨酸(Met) 非常相似,因为两者之间的唯一区别是SeMet中硫原子被硒原子取代,这样SeMet非特异性地结合到动物体蛋白质中。因此,在鸡蛋和牛奶中发现动物蛋白中会产生一个以SeMet 形式存在的“硒库”,从而将硒有效地转移给后代。此外,SeMet也可以储存在肌肉中,可以在动物在面对应激时释放出来。由于分解代谢,在机体面临应激时SeMet将从肌肉中的这个“硒库”中被释放并转化为H2Se,在硒酶中构建动物硒代半胱氨酸 (Schrauzer, 2000)。赛福硒Selsaf®作为含有活性硒成分的直接来源,可立即转化为 H2Se并形成GPx这样的硒酶,减少应激条件下的肌肉分解代谢进,从而降低应激对养殖动物生产性能的影响。
赛福硒Selsaf®对健康的益处
与未添加硒的动物 (对照组NC) 相比,赛福硒Selsaf® 可以提高硒酶(如GPx)活性,从而改善各种动物的抗氧化状态的能力,这已经在先前以奶牛为代表的试验中被证实(图一,未发表的数据)。
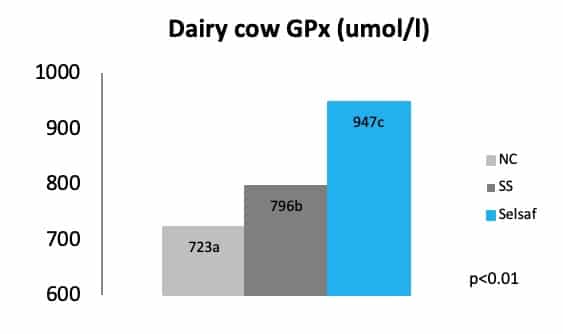
图1:对照组和亚硒酸钠组和赛福硒Selsaf®组GPx硒酶激活作用的对比
此外,最近一项肉牛试验表明,添加饲喂赛福硒Selsaf®能够增加机体抗自由基能力。这种抗自由基能力实际上是对自由基溶血半数红细胞所需时间的测量。图2中的数据清楚地看到,与SS(未公开数据)相比,自由基需要更长的时间来破坏赛福硒Selsaf®组动物样本的红细胞。这意味着与无机硒相比,赛福硒Selsaf®能显著性提高机体抗氧化能力(未公开数据)。
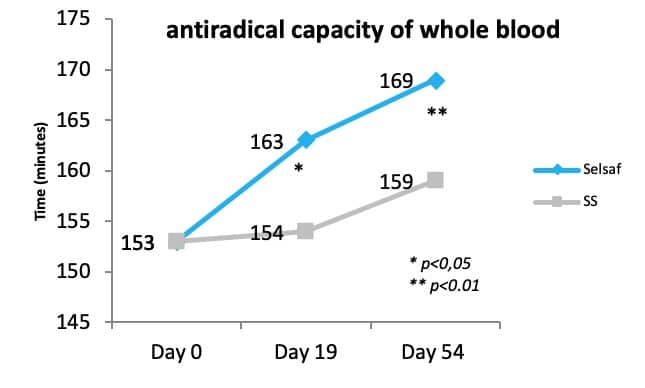
图2:赛福硒Selsaf®组与亚硒酸钠组肉牛全血的抗自由基数据对比
由于氧化应激通常与免疫力有关,因此添加饲喂赛福硒Selsaf®不仅可以提高动物的抗氧化能力,还可以影响动物的免疫系统。因此,在试验第0天和第19天分别接种牛疱疹病毒(BHV1) 疫苗后,赛福硒Selsaf®组的动物在血清中产生更多的中和抗体(图 3)(未发表的数据)。
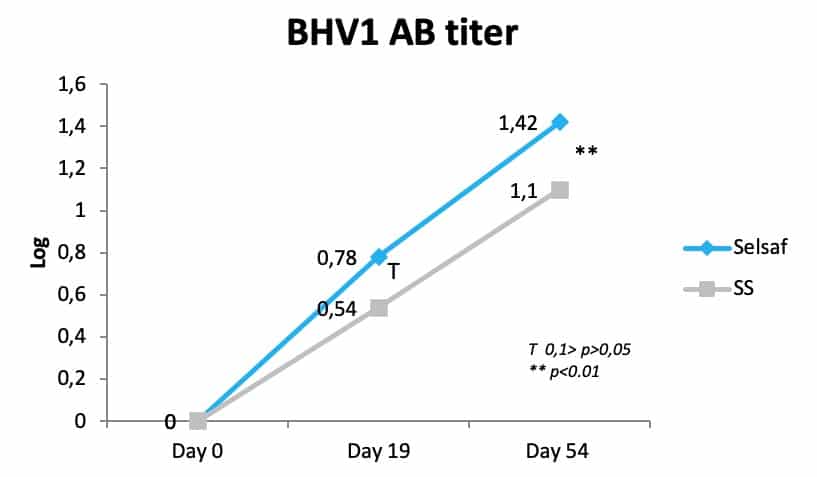
图3:赛福硒Selsaf®组和SS组肉牛血清中的 BHV1 抗体滴度
除了增强疫苗接种后的特异性免疫之外,通过测定的血清具有杀菌活性,即血清可以抑制某些细菌菌株的活性,从而表现出非特异性免疫系统,证明赛福硒Selsaf®还能够增强机体先天性免疫力。在各种牛品种中,有90%的个体对病原体感染的敏感性增加。数据显示在试验开始时,即运输后和开始添加饲喂硒之前,所有个体都对感染高度敏感(图 4)(未公开数据),开始添加硒后,赛福硒Selsaf®组中的个体表现出更强、更快的血清杀菌活性恢复能力,从而能够更好地抵抗病原体。
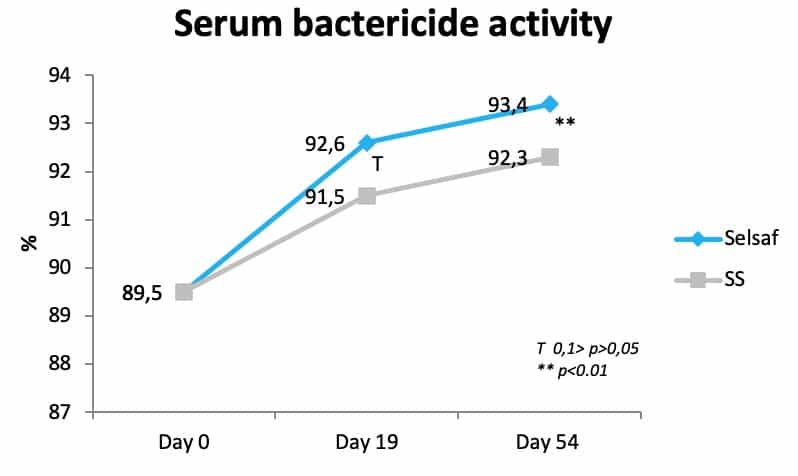
图4:赛福硒selsaf®组与亚硒酸钠组肉牛的血清杀菌活性对比
在实际生产中动物的生产性能
在实际生产中,牛的呼吸系统疾病通常是细菌性的,通常在运输等应激事件后6至10天内出现(Hjerpe,1983)。在运输等应激事件前添加饲喂赛福硒Selsaf®可以使非特异性免疫系统出现快速且有力的恢复,SS对照组肉牛的呼吸系统疾病相关的发病率为41.2%,赛福硒Selsaf®组仅为4.3%(图5A)。 此外,SS对照组的肉牛在康复期间积累的生长缺陷没有得到迅速恢复,这说明添加饲喂赛福硒Selsaf®的动物抗应激力也与生长性能有一定关系(图 5B)(未发表的数据)。
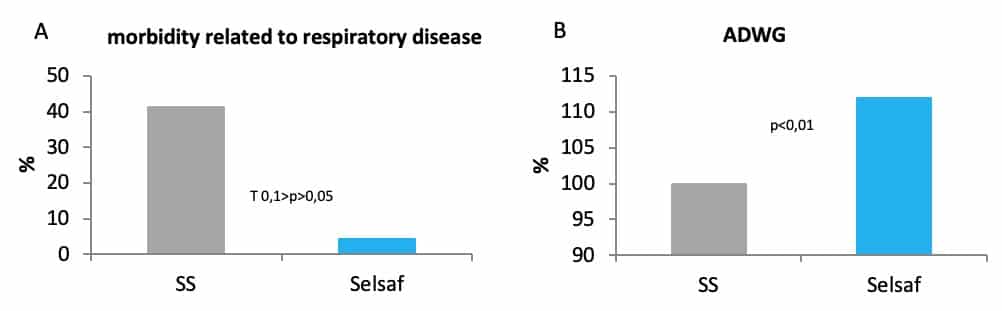
图5:赛福硒Selsaf®组肉牛与SS组患MRD (A)和ADWG (B)的百分比对比
赛福硒Selsaf®对动物总体健康和生产性能的影响也在家禽身上得到证实。在第一次试验中,在蛋鸡日粮中添加不同的硒来如SS、Selsaf®和合成的SeMet共计32周(从18 至50周龄)。图 6 (A-C) 所示,从试验结果清楚地发现,与其他硒源相比,赛福硒Selsaf®能够降低蛋鸡的死亡率(A),同时提高蛋鸡的产蛋率 (B) 和鸡蛋的饲料转化率(FCR) (C)。
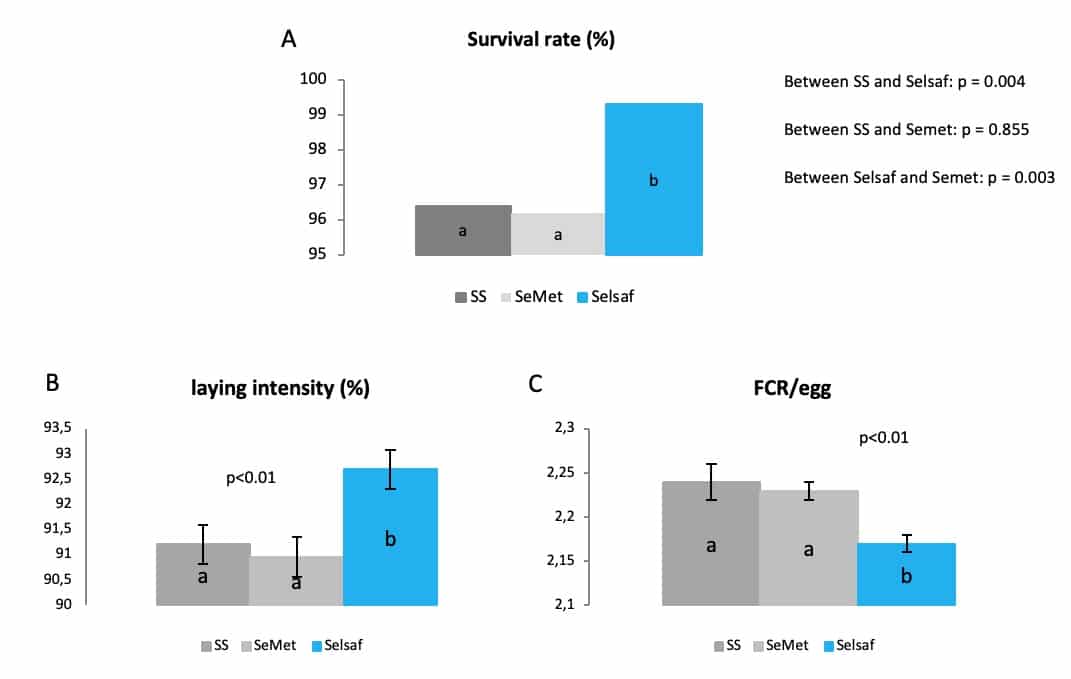
图6: 不同硒源对蛋鸡产蛋性能的影响
在第2个肉鸡试验中,由42日龄体重数据结果表明,与其他硒来源(无机和合成硒)相比,赛福硒Selsaf®更能改善肉鸡生产性能等方面(图7)(未发表的数据)。
因此,赛福硒Selsaf®不仅能够改善动物的抗氧化和免疫功能,而且能降低动物的发病率/死亡率和提高生产性能,为养殖者获益。
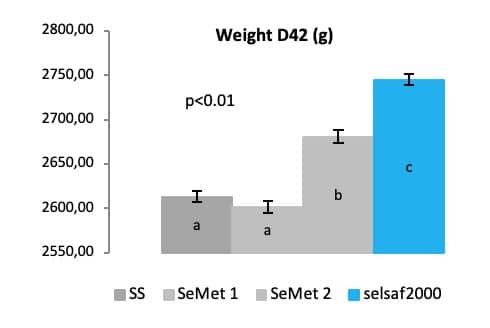
图7; 不同硒源对肉鸡生产性能的影响
对消费者的实际影响
最后,不仅养殖者从他们饲喂赛福硒Selsaf®的动物中获益,而且消费者在食用来自添加饲喂赛福硒Selsaf® 的动物最终产品时,也会体验到一些益处。赛福硒SeMet能将Se 很好的沉积在几种动物最终产品中,例如常食用的肉、奶、蛋(图 8),人们可从这些动物产品中获得天然硒,从而改善机体氧化状态,更好地抵抗病原体感染。
此外,众所周知,鸡蛋对脂质氧化敏感,是由于多不饱和脂肪酸的存在(Mohiti Asli 等,2008)。脂质氧化水平可以通过测定丙二醛 (MDA) 含量,丙二醛是脂质氧化过程中形成的二次氧化产物。 因此,MDA 的浓度可以作为一个参数来评估某些硒源对脂质氧化的影响。事实上,食品合理的脂质氧化值应低于3mg MDA/kg样品,上限为7-8mg MDA/kg(Faitarone 等,2016)。
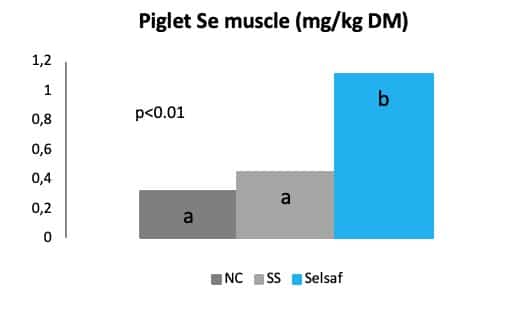
图8:不同来源的硒在肌肉中的沉积
因此,通过测定分析MDA指标可以证明赛福硒Selsaf® 能够降低保存期35天的鸡蛋的脂质氧化(图 9),这意味着用赛福硒Selsaf®能帮助增加鸡蛋的保质期。
肉类的脂质和蛋白质的氧化是最重要的肉表面酸败指标。一方面,肉中蛋白质的氧化可能会降低蛋白酶的活性,并增加肌原纤维蛋白交联,最终导致肉质更坚硬,另一方面脂质氧化可能干扰细胞膜的完整性,导致较低的保水能力,并形成干扰气味和风味的挥发性氧化产物(Rossi 等人,2015 年)。
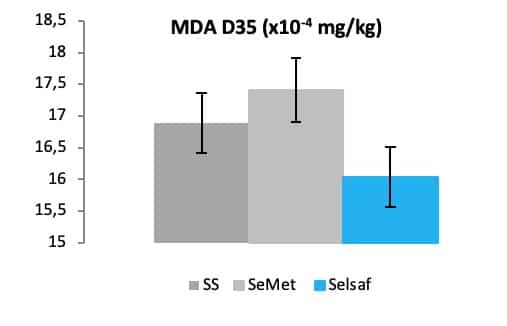
图9:不同来源硒对MDA指标的影响
最近的数据表明,给肉牛添加饲喂赛福硒Selsaf®可能会影响牛肉在储存期间的颜色、气味、表面湿度和整体外观。数据清楚地表明,从保存期第4天开始,赛福硒Selsaf®组牛肉的颜色得分更高,而另一个高分是在保存期最后2天;而从保存期第5天开始,赛福硒Selsaf®组牛肉的表面湿度才会变高。因此,给动物添加饲喂赛福硒Selsaf®,肉的整体外观质量从保存期第4天开始会显著性增加(Rossi 等,2015)(图 10)。
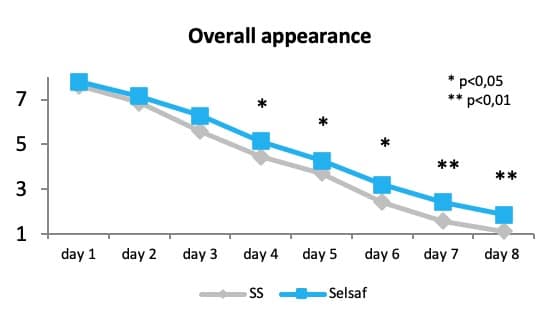
图10:不同来源硒对牛肉整体外观质量的影响
肉鸡试验(Rossi et al 2015)和最近肉鸡试验(未发表的数据)还表明,添加饲喂赛福硒Selsaf®不仅影响肉质的表观方面,保水能力(图 11A)和肉的嫩度(图 11B-C)也受到积极影响,与其他硒源甚至合成SeMet产品相比,积极影响程度更高。保水能力和肉嫩度分别通过测定滴水损失和剪切力,即破碎肉样品所需的强度或力度,破碎肉所需的力度越低,肉质越嫩。
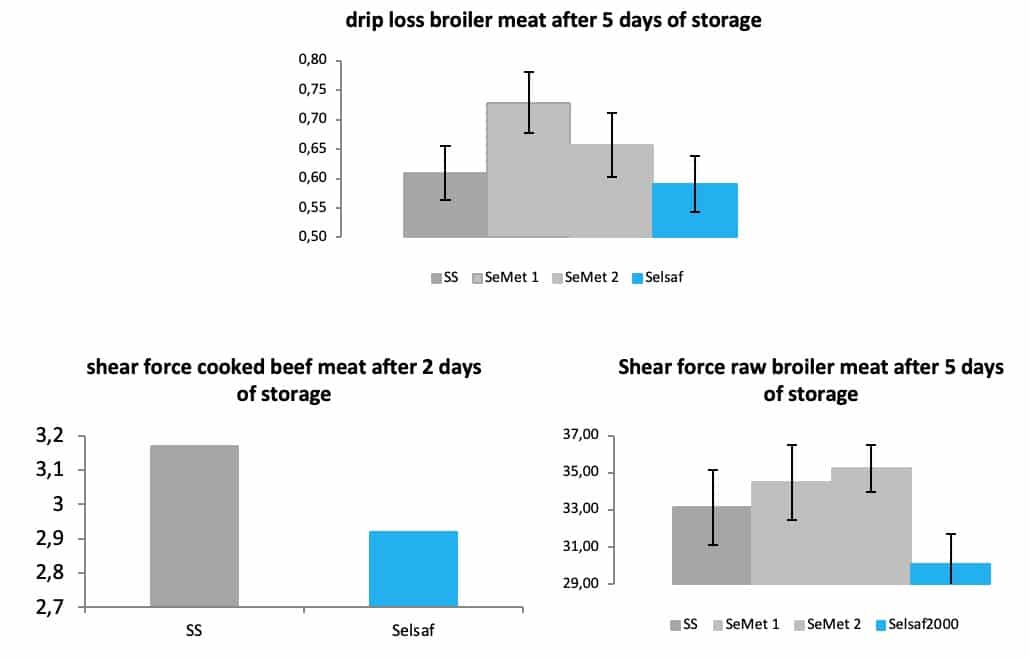
图11:不同硒源对肉质的影响
这些结果的原因可能是,与其他硒源相比,当动物添加饲喂赛福硒Selsaf®后,肌肉达到更高的抗氧化状态,如GPx和总抗氧化能力 (TAOC)的检测数据(图 12A-B)(未公开数据)。事实上,总抗氧化能力是测定综合非酶性抗氧化能力,这是有关抗活性氧 (ROS) 和抗氧化损伤的整体能力的信息。
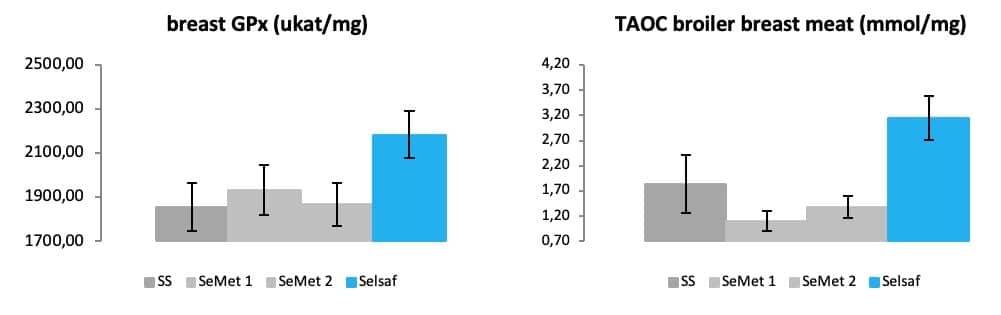
图 12:硒源对肉产品抗氧化状态的影响
总结
总之,赛福硒Selsaf® 是蛋氨酸硒和半胱氨酸硒的天然来源,为动物提供抗氧化和抗病原菌应激的双重保护,同时也通过维持动物健康和提高动物生产性能、提高消费者的满意度、保持保质期食品品质,为养殖者和消费者带来益处。
References
Brown K.m. and Arthur J. R. (2001). Selenium, selenoproteins and human health: a review. Public Health Nutr. 4(2B):593-599.
Faitarone A.B.G., Garcia E.A., Roça R.O., Andrade E.N., Vercese F. and Pelicia K. (2016). Yolk color and lipid oxidation of the eggs of commercial white layers fed diets supplemented with vegetable oils. Bras. Cienc. Avic. 18 doi.org/10.1590/1516-635X1801009-016.
Kieliszek M., Blazejak S. and Gientka I. (2015). Accumulation and metabolism of selenium by yeast cells. Appl. Microbiol. Biotechnol. 99: 5373-5382.
Hjerpe C.A. (1983). Clinical management of respiratory disease in feedlot cattle. Vat. Clin. North. Am. Large. Anim. Pract. 5(1): 119-142.
Lyons M.P., Papazyan T.T. and Surai P.F. (2007). Selenium in food chain and animal nutrition: Lessons from nature. Asian-Aust. J. Anim. Sci. 20(7): 1135-1155.
Mohiti-Asli M., Shariatmadari F., Lotfollahian H. and Mazuji M.T. (2007). Effects of supplementing layer hen diets with selenium and vitamin E on egg quality, lipid oxidation and fatty acid composition during storage. Can. J. Anim. Sci. 475-483.
Mehdi Y., Hornick J.L., Istasse L. and Dufrasne I. (2013). Selenium in the environment, metabolism and involvement in body functions. Molecules 18: 3292-3311.
Rossi C.A.S., Compiani R., Baldi G., Bernardi C.E.M., Muraro M., Marden J.-P. and Dell’Orto V. (2015). The effects of different selenium sources during the finishing phase on beef quality. Journal of Animal and Feed Sciences, 24, 2015, 93–99.
Schrauzer G.N. (2000). Selenomethionine: a review of its nutritional significance, metabolism and toxicity. J. Nutr. 130: 1653-1656.








Sorry, the comment form is closed at this time.